Canxi có nhiều dạng khác nhau tùy thuộc vào sự phân bố của nó trong cơ thể. Ban đầu, canxi được hấp thụ trong chế độ ăn uống thông qua nhiều loại thực phẩm giàu canxi. Trong khi các loại thực phẩm từ sữa chiếm tới 75% lượng canxi trong khẩu phần ăn, canxi cũng có thể được tìm thấy trong cá, thực phẩm tăng cường canxi hoặc các loại rau có lá màu xanh đậm. Khả dụng sinh học của canxi trong chế độ ăn uống thay đổi tùy thuộc vào các yếu tố vật chủ như tình trạng sức khỏe của cá nhân, tình trạng vitamin D và đa hình di truyền của thụ thể vitamin D (VDR). Điều này cũng có thể thay đổi dựa trên các mô hình hấp thụ khác nhau; Ví dụ, các loại rau lá xanh đậm không chỉ dồi dào canxi mà còn chứa oxalat và axit phytic, liên kết canxi trong ruột và ngăn chặn sự hấp thụ có ý nghĩa.
Trung bình, con người tiêu thụ khoảng 1000 mg canxi mỗi ngày. Sự hấp thụ canxi qua đường ruột sử dụng cả sự vận chuyển tích cực qua tế bào phụ thuộc vitamin D trong tá tràng và đoạn gần hỗng tràng và vận chuyển nội bào thụ động qua ruột non. Khoảng 350-400 mg được hấp thu bởi hệ thống đường tiêu hóa, với sự hỗ trợ của vitamin D. Vì khoảng 200 mg canxi được bài tiết trong dịch ruột mỗi ngày, nên sự hấp thụ thực sự là khoảng 150-200 mg mỗi ngày. Bài tiết canxi qua phân (khoảng 800 mg mỗi ngày) và nước tiểu (khoảng 200 mg mỗi ngày) [2]. Trong khi các vòng phản hồi ngược về nội tiết chủ yếu kiểm soát sự hấp thu canxi, các yếu tố tại chỗ cũng như các cơ chế tự nội tiết và cận nội tiết cũng đóng một vai trò nhất định. Ăn glucose, galactose và axit amin làm tăng hấp thu canxi. Sự hấp thụ cũng được điều chỉnh trong chế độ ăn uống có hàm lượng canxi thấp kinh niên. Ngược lại, sắt và fructose, cũng như canxi nhiều trong niêm mạc tiêu hoá, có thể làm giảm hấp thu canxi [3].
Sau khi được hấp thụ vào máu, canxi có thể ở nhiều dạng: liên kết với protein, không liên kết với protein và tự do. Trong khi lượng canxi này được điều chỉnh và duy trì chặt chẽ, điều quan trọng cần lưu ý là canxi ngoại bào chiếm khoảng 0,1% tổng lượng canxi dự trữ trong cơ thể. Nồng độ canxi trong tế bào chất thấp hơn so với nồng độ canxi ngoại bào, nhưng đáng chú ý là nồng độ bên trong các bào quan nội bào cụ thể như ty thể và mạng lưới nội chất lại cao. Tổng cộng, canxi nội bào chiếm khoảng 1% tổng lượng canxi cơ thể.
Canxi gắn với protein trong huyết thanh chủ yếu được tạo phức với albumin, một protein huyết tương 66,5 kDa có khả năng liên kết và đệm đáng kể; mỗi phân tử albumin có ~ 30 vị trí liên kết canxi [4]. Dạng này chiếm từ 41% đến 46% tổng lượng canxi huyết thanh [1, 2]. Trong khi albumin là protein huyết tương chiếm ưu thế nhất có khả năng liên kết với canxi, điều này cũng xảy ra với các globulin khác. Dạng canxi này, giống như hầu hết các protein mà chúng liên kết, thường không được lọc tự do bởi cầu thận.
Canxi không gắn với protein trong huyết thanh chiếm 7-9% tổng lượng canxi huyết thanh và thường được tạo phức với các anion, chẳng hạn như citrat và phosphat [1, 2]. Vì canxi này không liên kết với protein, nó có thể được thận lọc tự do.
Số phận cuối cùng của canxi trong máu là canxi tự do hoặc canxi ion hóa. “Ion hóa” không chính xác về mặt kỹ thuật, vì tất cả canxi trong cơ thể đều bị ion hóa, và thuật ngữ đúng hơn là canxi “tự do” [5]. Tuy nhiên, thuật ngữ “ion hóa” vẫn được sử dụng rộng rãi bởi các bác sĩ lâm sàng và phòng xét nghiệm. Dù vậy, canxi này không có trong huyết thanh và có thể tự do khuếch tán qua màng tế bào. Đây là tỷ lệ canxi lớn nhất trong huyết thanh, chiếm khoảng từ 48% đến 50% tổng lượng canxi huyết thanh [1, 2].
Khi đo lượng canxi huyết thanh, tổng lượng canxi huyết thanh được báo cáo bởi các phòng xét nghiệm – kết quả này bao gồm tất cả canxi tự do hoặc ion hóa và canxi liên kết với protein và phức tạp. Tùy thuộc vào phòng xét nghiệm, mức bình thường điển hình cho mức tổng lượng calci trong huyết thanh là 8,5–10,5 mg/dL. Tuy nhiên, có tầm quan trọng sinh lý lớn hơn là mức canxi tự do hay canxi “ion hóa”. Như đã nói ở trên, canxi tự do có thể bị thay đổi bởi khả năng gắn kết với canxi của protein huyết tương, chủ yếu là albumin. Hơn nữa, khả năng liên kết canxi của albumin có thể bị ảnh hưởng bởi độ pH hoặc liên kết thuốc khác. Vì các ion hydro cũng liên kết với albumin, khi có nhiều, cũng như với pH thấp hơn, ái lực liên kết với canxi tự do thấp hơn, do đó làm tăng phần calci bị ion hóa. Điều ngược lại cũng đúng. Với chứng kiềm hoá máu, ít ion hydro liên kết với albumin hơn, làm tăng ái lực với canxi tự do và do đó làm giảm phần canxi tự do. Tình huống này với tình trạng kiềm máu có thể dẫn đến hạ canxi đe dọa tính mạng, nếu kéo dài hoặc nghiêm trọng.
Một chiến lược để ước tính canxi huyết thanh chính xác hơn là bằng cách “hiệu chỉnh” nồng độ canxi toàn phần trong huyết thanh theo nồng độ albumin huyết thanh. Thực hành này dựa trên giả định rằng albumin liên kết với canxi một cách cố định khi pH huyết thanh bình thường – khi nồng độ albumin thấp hơn, tổng lượng canxi đo được trong phòng xét nghiệm bị thấp do giảm tổng lượng canxi gắn với albumin. Để điều chỉnh lỗi này, chúng tôi thường sử dụng công thức dưới đây:
Canxi hiệu chỉnh = tổng lượng canxi huyết thanh đo được + 0,8 [4 – albumin tính bằng g/dL]
Một chiến lược khác để đánh giá chính xác hơn canxi tự do, có hoạt tính sinh lý là đo canxi ion hóa trực tiếp trong phòng xét nghiệm. Giá trị bình thường điển hình của canxi “ion hóa” tự do là khoảng 1,2 mmol/L, hoặc 2,4 meq/L [1].
Xương là cơ quan dự trữ canxi chính trong cơ thể
Nguồn dự trữ canxi chính trong cơ thể con người là xương và răng, chiếm khoảng 99% tổng lượng canxi cơ thể [1, 2]. Để hiểu về cân bằng nội môi và chuyển hóa canxi trong xương, trước tiên điều quan trọng là phải hiểu những kiến thức cơ bản về cấu trúc xương. Xương người được cấu tạo chủ yếu từ chất nền và muối canxi hữu cơ. Trong chất nền là collagen, chất quan trọng đối với độ bền của gân và chất nền, là sự kết hợp của chondroitin sulfat và axit hyaluronic được tiết ra bởi nguyên bào xương. Xen kẽ với chất nền là các muối canxi – chúng có thể là tinh thể hoặc vô định hình. Các muối vô định hình bao gồm khoảng 1% tất cả các muối trong xương và đại diện cho một phần canxi dễ “tiêu hóa” để nhanh chóng được giải phóng vào huyết thanh để duy trì phạm vi canxi sinh lý chặt chẽ. Tuy nhiên, phần tinh thể chiếm một tỷ lệ lớn hơn nhiều, xấp xỉ 99%. Đây là hydroxyapatite, được đại diện bởi công thức hóa học Ca10 (PO4) 6 (OH) 2 [1]. Hình 1.1 tóm tắt sự phân bố canxi qua các ngăn khác nhau.
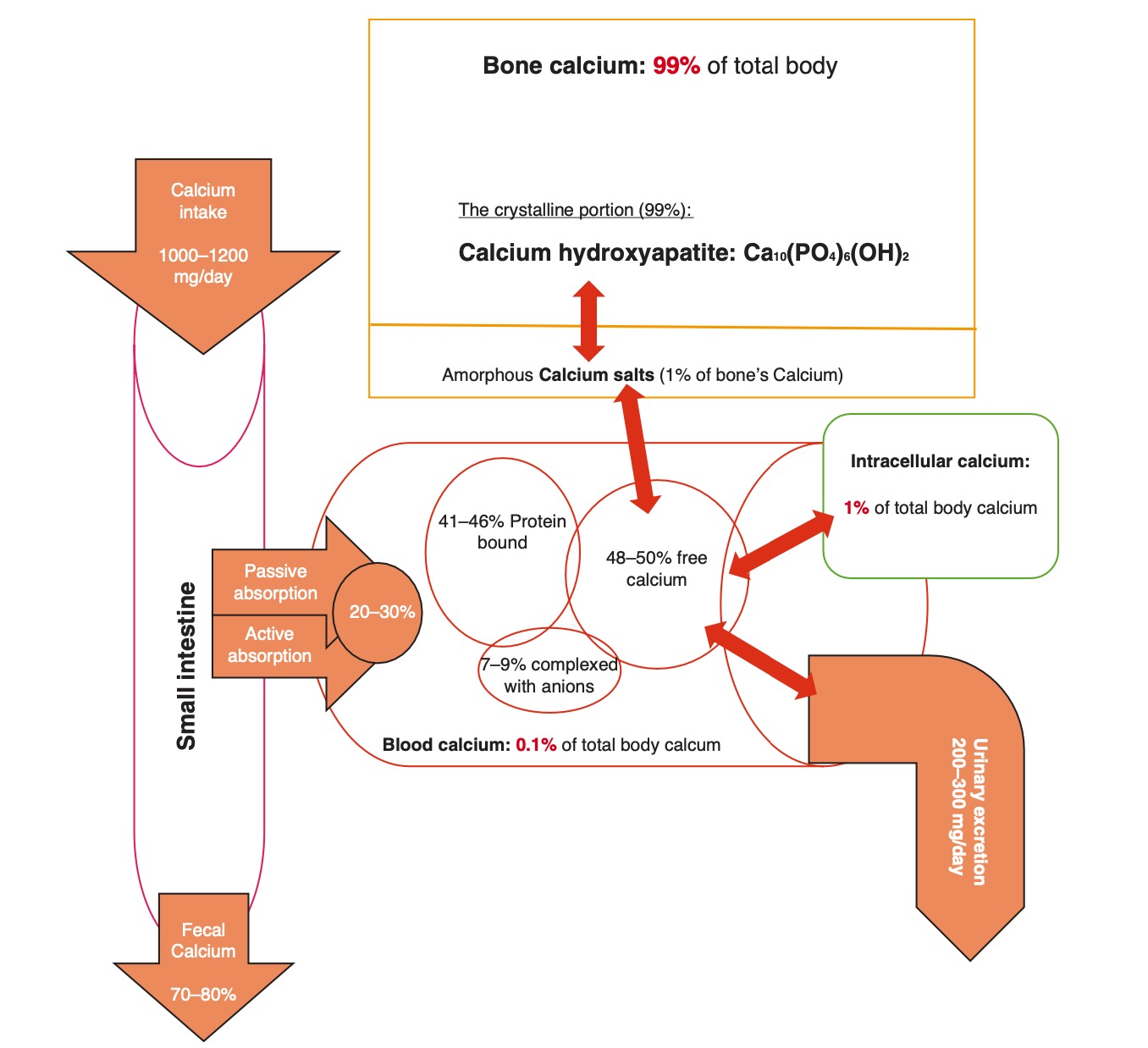
Hình 1.1. Cân bằng nội môi hàng ngày và phân phối trong các mô của canxi
Các loại hormones điều hoà Canxi
Như đã đề cập trước đó, mức canxi trong máu được điều chỉnh rất chặt chẽ trong khoảng 8,5–10,5 mg/dL, tùy thuộc vào từng phòng xét nghiệm. Sự tương tác phức tạp này liên quan đến nhiều loại hormone và chất điện giải bao gồm hormone tuyến cận giáp (PTH), calcitonin, vitamin D, phốt pho, magiê và yếu tố tăng trưởng nguyên bào sợi 23 (FGF23).
Hormone tuyến cận giáp
Hormone tuyến cận giáp (PTH) là một hormone polypeptide 84 axit amin đóng vai trò là chất điều hòa chính của canxi tự do trong máu. Chất này được giải phóng từ các tế bào chính của tuyến cận giáp – bốn tuyến hình quả hạnh ở mặt sau của tuyến giáp. Giải phóng PTH hoạt động theo cách phản hồi ngược, trong khi mức canxi thấp hơn kích thích giải phóng PTH, hoạt động mạnh hơn khi canxi huyết thanh giảm đột ngột [6]. PTH liên kết với thụ thể PTH, một thụ thể kết hợp với protein G, tín hiệu thông qua cả adenylate cyclase và phospholipase C. Sự liên kết này chủ yếu xảy ra thông qua đầu tận cùng N, với ái lực cao với thụ thể trong 34 axit amin đầu tiên của PTHH phân tử. Trong vòng vài phút kể từ khi PTH liên kết với thụ thể của nó, thụ thể sẽ được giải mẫn cảm và thụ thể được nội hóa [7].
Thụ thể cảm nhận canxi ngoại bào (CaSR) hoạt động như một cảm biến canxi tự do và được biểu hiện trong vô số mô. Sự biểu hiện của nó ở mức độ tế bào cận giáp, tế bào C của tuyến giáp, và ở quai henle của thận cho phép CaSR đóng một vai trò trung tâm trong việc cân bằng nội môi canxi. Các ion cat- hóa trị hai khác là chất chủ vận thụ thể tiềm năng đối với CaSR, đặc biệt là magiê. Trong tuyến cận giáp, nồng độ canxi tự do tăng cao sẽ kích hoạt các con đường nội bào dẫn đến ức chế giải phóng PTH và biểu hiện gen PTH. Ở cấp độ tế bào C của tuyến giáp, sự hoạt hóa CaSR dẫn đến sự xuất bào của calcitonin. Ở thận, chức năng được biết đến nhiều nhất của CaSR là ở mức độ của quai Henle, nơi việc kích hoạt CaSR làm giảm sự tái hấp thu của cả canxi và magiê.
Trong tuần hoàn, ngoài 84-axit amin peptit còn nguyên vẹn, một số đoạn của hoocmôn còn có mặt. Vùng tận cùng C không hoạt động của PTH cũng có mặt, vùng này có thời gian bán hủy dài hơn, đặc biệt là trong bệnh thận. Thời gian bán hủy của PTH nguyên vẹn (iPTH) là từ 2 đến 4 phút. Các phương pháp đo PTH trong phòng xét nghiệm đã trải qua một số cải tiến, với các loại xét nghiệm PTH gần đây hơn được hướng tới đầu cuối N hoạt động sinh học. Vì vậy, về lý thuyết, điều quan trọng là khi so sánh các mức PTH để sử dụng cùng một xét nghiệm mọi lúc vì chúng có thể khác nhau giữa các phòng xét nghiệm. Ngày nay, hầu hết các phòng xét nghiệm thương mại đều sử dụng thử nghiệm iPTH thế hệ thứ hai. Xét nghiệm này đo toàn bộ phân tử (PTH 1–84) và các đoạn lớn hơn (ví dụ PTH 7–84). Các xét nghiệm PTH toàn bộ, chỉ đo PTH 1–84, có sẵn nhưng ít được sử dụng hơn.
PTH có nhiều chức năng để nâng mức canxi huyết thanh đã giảm trở lại mức sinh lý: đầu tiên, nó hoạt động trên xương để kích thích bài tiết axit xitric và axit lactic từ tế bào hủy xương để giúp hòa tan muối canxi của xương, đóng vai trò như một nguồn canxi để ngay lập tức giải phóng vào máu. Nó cũng kích thích sự biệt hóa tiền mô xương và điều hòa giảm osteoprotegerin, một chất ức chế thường dùng để ngăn chặn sự hòa tan xương [1]. Cả hai hành động này đều thúc đẩy quá trình hòa tan xương tiếp tục để giải phóng muối canxi trong máu. Các giải pháp lâu dài để tăng canxi huyết thanh đạt được bằng các hoạt động PTH trong thận. Tại đây, PTH có tác dụng [1] tăng hoạt động của 1-alpha hydroxylase trong tế bào ống lượn gần và tăng cường hoạt hóa vitamin D để từ đó tăng hấp thu canxi ở đường tiêu hóa và [2] tăng hấp thu canxi ở thận chủ yếu ở ống lượn gần và quai Henle [2]. Sự bài tiết PTH cũng được tăng cường bởi dopamine, catecholamine và prostaglandin E2 [2]. Hạ magie máu nghiêm trọng (<0,8 meq/L) có liên quan đến suy tuyến cận giáp do ức chế giải phóng PTH từ tuyến cận giáp và ức chế hoạt động của nó trên các cơ quan đích.
Vitamin D
Hoạt động cùng với PTH, vitamin D là một loại hormone đóng vai trò không thể thiếu trong việc điều hòa canxi huyết thanh. 1,25-dihydroxycholecalciferol, hoặc vitamin D hoạt tính, cần thiết cho các tác động sinh lý tích cực lên nồng độ canxi. Vitamin D là một loại hormone dựa trên cholesterol có thể được kích hoạt trong da từ tia cực tím (UV) hoặc được tiêu hóa dưới nhiều hình thức trong chế độ ăn uống. Trong da, 7-dehydrocholesterol được chuyển đổi thành cholecalciferol (vitamin D3), một phản ứng được xúc tác bởi tia UVB. Vitamin D cũng có thể được tiêu thụ trong chế độ ăn uống, ở dạng thực vật (ergocalciferol, vitamin D2) hoặc ở dạng động vật (cholecalciferol). Từ đó, vitamin D không hoạt động được liên kết với protein liên kết của nó (protein liên kết vitamin D) trong máu và được đưa đến gan để thực hiện phản ứng hydroxyl hóa đầu tiên – quá trình hydroxyl hóa đầu tiên này, bởi nhiều enzym cytochrom P-450 (CYPs) bao gồm cả CYP2R1 , CYP27A1 và CYP2D25, tạo thành 25-hydroxyvitamin D3 (25-OH VitD3 hoặc 25-hydroxycholecalciferol) [9, 18]. 25-OH VitD3 là dạng vitamin D lưu hành chính và được đo trên lâm sàng như một dấu ấn sinh học về tình trạng vitamin D. 25-OH VitD3 được vận chuyển đến thận nơi 1-α-hydroxylase xúc tác quá trình hydroxyl hóa thứ hai, tạo thành 1,25-dihydroxyvitamin D (1,25-OH VitD3 hoặc 1,25-dihydroxycholecalciferol) trong ống lượn gần, được coi là dạng hoạt động sinh lý của vitamin D. Sự hấp thu 25-OH VitD3 của ống thận sử dụng nội chất tế bào được megalin hỗ trợ [18].
1,25-OH VitD3 có một thụ thể nội nhân, VDR, và tạo thành một phức hợp dị phân tử 1,25-OH VitD3-thụ thể vitamin D được kích hoạt/thụ thể retinoic X (VDR/RXR) trong nhân tế bào. Phức hợp VDR/RXR liên kết với nhiều chuỗi DNA để tạo điều kiện thuận lợi hoặc ngăn chặn sự biểu hiện của các gen mục tiêu vitamin D [18]. 1,25-OH VitD3 là dạng vitamin D hoạt động và có thể hoạt động trên ruột để tăng hấp thu canxi qua đường tiêu hóa và tăng tái hấp thu canxi ở thận. Ở cấp độ xương, 1,25-OH VitD3 tăng tốc quá trình hủy xương khi bệnh nhân ở trạng thái cân bằng canxi âm. Vai trò tích cực của vitamin D để đạt được mức cân bằng canxi tích cực không rõ ràng, nhưng nó được cho là hoạt động như một chất hỗ trợ cho quá trình khoáng hóa xương.
Theo kiểu phản hồi ngược, việc tăng mức 1,25-OH VitD3 làm giảm hoạt tính 1-alpha hydroxylase và tăng hoạt tính 24-alpha hydroxylase, do đó xúc tác phản ứng thành 24,25-hydroxyvitamin D3, một chất chuyển hóa không hoạt động [2]. 1,25-OH VitD3 làm tăng biểu hiện FGF23 bởi tế bào xương, dẫn đến tăng phosphat niệu và ức chế bài tiết PTH ở mức độ của tuyến cận giáp. Đo nồng độ trong huyết thanh 1,25-OH VitD3 không tương quan với tình trạng vitamin D vì thiếu hụt vitamin D dẫn đến cường cận giáp thứ phát, do đó làm tăng 1-α-hydroxyl hóa và sau đó là mức 1,25-OH VitD3 bình thường.
Calcitonin
Trái ngược với PTH, calcitonin là một loại hormone được tiết ra từ các tế bào C của tuyến giáp để đáp ứng với nồng độ canxi trong huyết thanh tăng cao [6]. Calcitonin có tác dụng cả trong xương và thận để khẳng định tác dụng của nó đối với canxi. Trong xương, calcitonin có tác dụng nhanh chóng để giảm hoạt động và biệt hóa của tế bào hủy xương [6]. Điều này dẫn đến giảm sự phân hủy của chất nền xương và giảm giải phóng canxi vào máu [8]. Ở thận, calcitonin được cho là hoạt động ở cả ống lượn gần và quai Henle để làm giảm tái hấp thu canxi thông qua kích hoạt các cơ chế xuyên tế bào [2]. Tuy nhiên, vai trò sinh lý của calcitonin trong nội môi bình thường của canxi vẫn chưa rõ ràng vì “thiếu hụt calcitonin” ở những bệnh nhân đã phẫu thuật cắt toàn bộ tuyến giáp không ảnh hưởng đến canxi huyết thanh.
Peptide liên quan đến PTH
Peptide liên quan đến PTH, hoặc PTHrP, ban đầu được phát hiện có liên quan đến tăng calci của bệnh ác tính và được mã hóa trên nhiễm sắc thể 12. Đầu mối amin của PTH và PTHrP chia sẻ 8 trong số 13 axit amin giống nhau và có khả năng giải thích khả năng liên kết của nó với thụ thể PTH và thực hiện các hành động sinh lý tương tự như PTH. Trong điều kiện sinh lý bình thường, PTHrP được mô tả là hoạt động trong quá trình tăng trưởng tế bào. Trong các quá trình bệnh lý, chẳng hạn như ung thư đường tiêu hóa trên, đầu và cổ, u lympho và hệ thống sinh sản nữ, PTHrP có thể hoạt động như một chất chủ vận trên thụ thể PTH và tạo ra tăng calci huyết không được điều chỉnh thông qua cơ chế phản hồi ngược [17 ].
Sự điều hoà phốt pho
Phốt pho đóng một vai trò quan trọng trong quá trình chuyển hóa năng lượng khắp cơ thể, cơ chế điều hòa và nội môi của nó gắn bó mật thiết với quá trình chuyển hóa canxi. Phốt pho tham gia vào quá trình sản xuất năng lượng thông qua việc tạo ra adenosine triphosphate, tính toàn vẹn của màng tế bào, quá trình đệm, phiên mã và tín hiệu tế bào [2, 10, 11]. Việc hấp thụ photpho có thể thông qua photphat vô cơ hoặc photphat hữu cơ. Các nguồn vô cơ có xu hướng là những nguồn có chất phụ gia hoặc chất bảo quản và dễ hấp thụ hơn nhiều. Ngược lại, phosphat hữu cơ chủ yếu đến từ các nguồn sữa hoặc thịt và ít được hấp thụ hơn [11]. Tùy thuộc vào chế độ ăn uống, lượng hấp thụ phốt pho hàng ngày nằm trong khoảng 700 đến 2000 mg, với mức độ hấp thụ thay đổi tùy thuộc vào mức độ và nguồn cung cấp [2, 11]. Photpho trong huyết tương có thể ở dạng este, photpholipit hoặc photphat vô cơ. Phosphat vô cơ là giá trị thường được đo trong phòng xét nghiệm, với các giá trị thông thường trong phòng xét nghiệm nằm trong khoảng từ 2,5 đến 4,0 mg/dL. Điều này đại diện cho photphat ion hóa tuần hoàn, có thể là HPO42− hoặc H2PO4−, có ở tỷ lệ 4: 1 trong huyết thanh khi pH ở trong phạm vi sinh lý bình thường [12]. Mặc dù đo lường lâm sàng về photphat ngoại bào, con số này chỉ chiếm dưới 1% tổng lượng photpho trong cơ thể, trong khi phần lớn lượng photpho này nằm trong xương ở dạng hydroxyapatite [2, 10].
Tương tự như canxi, quá trình điều hòa phốt pho là một tác động qua lại giữa hệ tiêu hóa, xương và thận và được điều chỉnh thông qua cơ chế phản hồi ngược và dưới sự kiểm soát của nội tiết tố. Như đã đề cập, sự hấp thụ phốt pho trong ruột phụ thuộc vào hình thức ăn vào, cũng như mức 1,25-OH VitD3, điều chỉnh sự hấp thụ phốt pho ở đây. Điều này chủ yếu xảy ra ở tá tràng và hỗng tràng, thông qua cotransport natri-phosphat loại 2b (NaPi 2b), tương tự như loại 2a và loại 2c được tìm thấy ở thận, với sự vận chuyển thụ động bổ sung xảy ra theo từng tế bào [2, 9].
Thận là cơ quan điều hòa chính mức phốt pho huyết thanh trong cơ thể. Với trọng lượng phân tử thấp, phốt pho được lọc tự do ở cầu thận và được tái hấp thu chủ yếu ở ống lượn gần. Có một số chất vận chuyển tham gia vào quá trình tái hấp thu photpho ở đây: NaPi 2a (trao đổi ba natri lấy một photphat hóa trị hai/HPO42−), NaPi 2c (trao đổi hai natri lấy một photphat hóa trị hai/HPO42−) và PiT-2 (trao đổi hai natri lấy một photphat đơn hóa trị/H2PO4−). Tất cả các chất vận chuyển ở ống lượn gần đều cần có hai điều kiện để vận chuyển: năng lượng và natri. Các chất vận chuyển và sau đó là xử lý phốt pho ở thận bị ảnh hưởng bởi nhiều loại hormone và tình trạng sinh lý. Ví dụ, 1,25-OH VitD3, kiềm chuyển hóa, và triiodothyronine đều làm tăng tái hấp thu phosphate ở ống lượn gần. PTH, estrogen, dopamine, toan chuyển hóa, glucocorticoid và các đợt tăng huyết áp cấp tính đều làm tăng mất phosphat ở ống lượn gần [2]. Tuy nhiên, hormone nổi bật nhất liên quan đến điều hoà phốt pho là yếu tố tăng trưởng nguyên bào sợi 23, hoặc FGF23.
Yếu tố tăng trưởng nguyên bào sợi 23 (FGF23)
FGF23 là một glycoprotein 32 kDa được tiết ra bởi các tế bào xương và nguyên bào xương để đáp ứng với những thay đổi của lượng phốt pho; nó là một hormone trung tâm trong việc duy trì cân bằng nội môi phốt pho. Ở những đối tượng khỏe mạnh có nồng độ phốt pho trong huyết thanh trong phạm vi sinh lý, nồng độ huyết thanh FGF23 thay đổi để đáp ứng với những thay đổi của lượng phốt pho trong chế độ ăn. Các thụ thể FGF (FGFR1–4) là các thụ thể FGF23 và được biểu hiện phổ biến trên các mô khác nhau. Vai trò ngoài xương của FGF23 chưa được hiểu rõ; người ta tin rằng vai trò sinh lý chính của FGF23 là điều hòa phốt pho trong thận và xương. Ngoài FGFR ở các cơ quan đích, sự đồng biểu hiện trên màng của protease α-klotho xác định ảnh hưởng của FGF23 trên các cơ quan đích. Sự thiếu hụt α-klotho sẽ biểu hiện với kiểu hình tương tự như sự thiếu hụt FGF23.
Trong thận, FGF23/Klotho tạo phức hợp với FGFR để tạo ra hiệu ứng phosphaturic bằng cách giảm sự biểu hiện của NaPi 2a và NaPi 2c trong các tế bào ống gần và do đó ức chế tái hấp thu phốt pho. Tác dụng phụ của phức hợp FGF23/Klotho là làm giảm hoạt động của 1-alpha hydroxylase, do đó làm giảm sự hình thành vitamin D hoạt động [13]. Trục nội tiết tố FGF23 có tầm quan trọng đặc biệt và được quan tâm trong quá trình chuyển hóa khoáng chất của xương trong bệnh thận mãn tính. Khi tốc độ lọc cầu thận giảm, tổng khối lượng nephron giảm, nhưng khả năng duy trì cân bằng nội môi phốt pho của thận được phục hồi nhờ sự gia tăng bài tiết FGF23 qua xương và do đó tăng lượng phosphat niệu đơn nephron (Hình 1.2). Đây là một cơ chế thích ứng để khôi phục cân bằng nội môi phốt pho và khớp tổng lượng phốt pho hấp thụ với sản lượng phốt pho trong giai đoạn đầu của bệnh thận. Tuy nhiên, cơ chế bù trừ này sẽ bị lấn át trong giai đoạn cuối của bệnh thận.
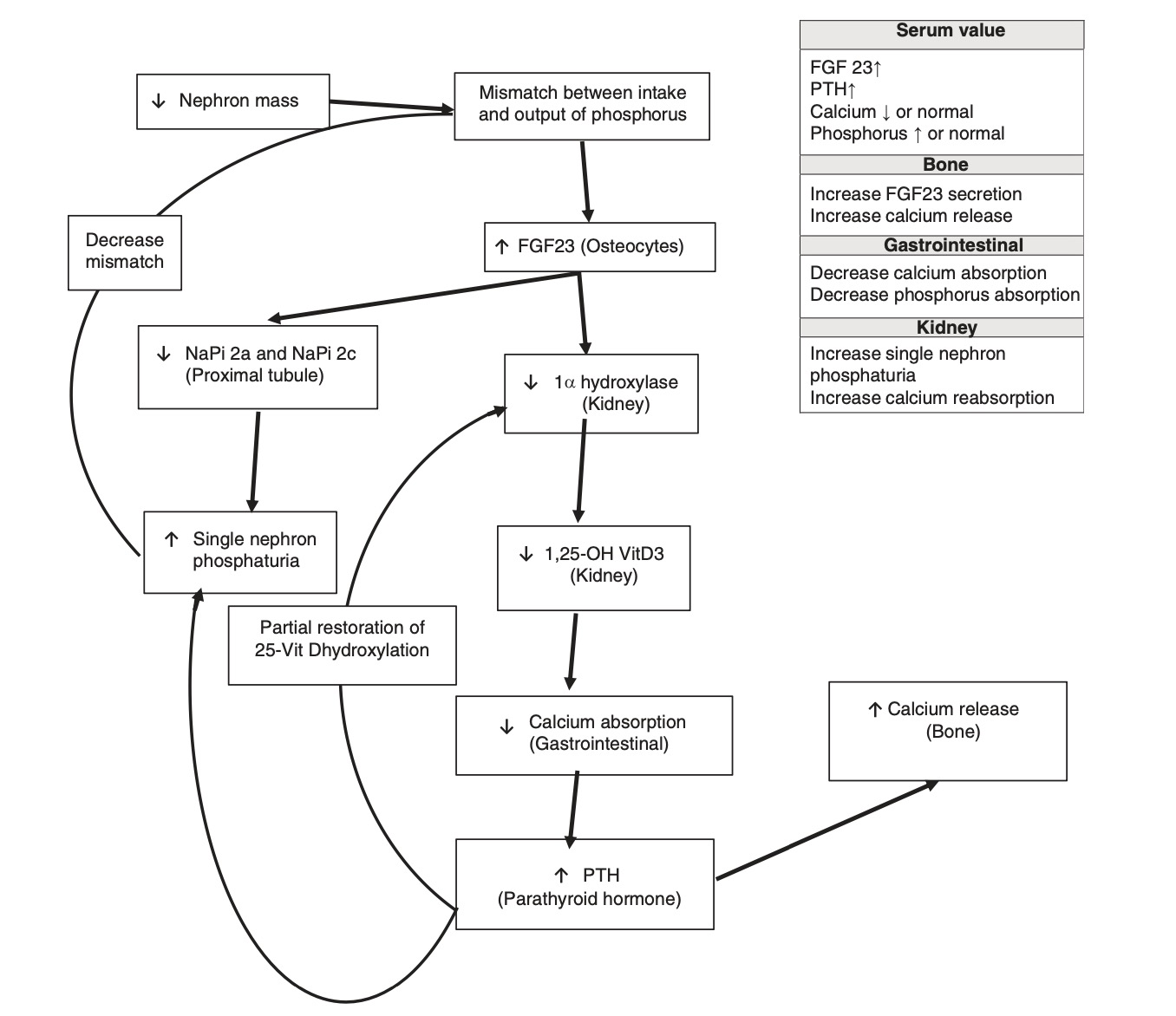
Hình 1.2. Đáp ứng thích nghi với bệnh thận
Một tác động bổ sung của mức lưu hành cao của FGF23 trong bệnh thận mãn tính là làm giảm hoạt động của 1-α hydroxylase và do đó giảm chuyển đổi 25-OH VitD3 thành 1,25-OH VitD3. Trạng thái VitD3 1,25-OH thấp dẫn đến giảm nồng độ canxi huyết thanh do giảm hấp thu đường tiêu hóa và cường cận giáp thứ phát. Kết quả thực là phục hồi mức phốt pho bằng cách: (a) tăng phốt phát qua trung gian của cả PTH và FGF23 ở mức cao và (b) giảm hấp thụ phốt pho qua trung gian 1,25-OH VitD3 thấp. Hạ calci huyết do giảm hấp thu qua đường tiêu hóa được chống lại bởi sự gia tăng giải phóng calci từ xương qua trung gian PTH. Tuy nhiên, với bệnh thận mãn tính, xương trở nên đề kháng với PTH, và cần phải có hàm lượng cao hơn để có tác dụng tương tự. Vòng luẩn quẩn này tiếp tục diễn ra khi bệnh thận mãn tính tiến triển và dẫn đến các thông số xét nghiệm thường thấy với bệnh thận tiến triển, bao gồm tăng phôtpho, hạ calci máu và mức PTH tăng cao. Các tài liệu gần đây cho thấy nồng độ FGF23 tăng cao với phì đại thất trái, vôi hóa mạch máu, và tử vong do mọi nguyên nhân và tim mạch [14].
Bs.Ths. Lê Đình Sáng, Khoa Nội tiết, Bệnh viện HNĐK Nghệ An
TÀI LIỆU THAM KHẢO
Bệnh viện Hữu nghị đa khoa Nghệ An là bệnh viện tuyến tỉnh đầu tiên trong cả nước đủ điều kiện thực hiện kỹ thuật ghép gan
Đoàn công tác của Bộ Y tế và Bệnh viện Bạch Mai đến thăm và làm việc tại Bệnh viện Hữu nghị đa khoa Nghệ An để hỗ trợ xây dựng bệnh viện hạng đặc biệt
Truyền thông và ứng dụng chuyển đổi số Y tế tại bệnh viện Hữu nghị đa khoa Nghệ An – Hưởng ứng ngày chuyển đổi số quốc gia năm 2024
Bệnh viện Hữu nghị Đa khoa Nghệ An tiếp tục thực hiện thành công lấy, ghép tạng từ người cho chết não

Copyright © 2024 BỆNH VIỆN HỮU NGHỊ ĐA KHOA NGHỆ AN